Reacțiile chimice cu modificarea stării de oxidare se numesc reacții de
oxido-reducere sau reacţii redox.
Reacţiile cu transfer de electroni sunt reacțiile în care întotdeauna
exista cel putin douǎ elemente care îşi modificǎ starea de oxidare.
Orice proces redox este alcătuit din două semireacţii:
Ox1 + ne- ⇌ Red1 reacție de reducere
(R.R.)
Red2 ⇌ Ox2 + ne- reacție de
oxidare (R.O.)
Procesul
de oxidare este transformarea chimică ce are loc cu cedare
de electroni. În procesul de oxidare, numărul de oxidare creşte.
Procesul
de reducere este transformarea ce are loc cu acceptare de electroni. În procesul de
reducere, numărul de oxidare scade.
Specia
chimică (atom, ion) care cedează electronii acceptaţi în procesul de
reducere, deci favorizează reacţia de reducere, se numeşte agent reducător (A.R.). Agentul
reducător se oxidează.
- metalele
- cationii
în treaptă inferioară de oxidare (Fe2+ , Sn2+ ,etc.)
- nemetale în
trepte inferioare de oxidare (S2-, H2PO2-,
etc.),
- H2
, C, CO, H2S, HCl.
Specia
chimică (atom, ion) care acceptă electronii cedaţi în procesul de
oxidare, deci favorizează reacţia de oxidare, se numeşte agent oxidant (A.O.). Agentul oxidant se reduce.
- nemetale (O2 , Cl2 , F2 , S),
- ioni metalici la trepte superioare de oxidare
( Fe3+, Hg2+, etc.)
- săruri
cu ioni poliatomici care conţin elemente cu stare de oxidare maximă (KMnO4, K2Cr2O7
, K2CrO4 );
- apă oxigenată, peroxizi
- HNO3, H2SO4 concentrat,
etc.
* Reacţii de oxido-reducere au loc şi în
organismele vii. Un proces cu caracter de universalitate pentru toate
organismele aerobe îl constituie oxidarea hidrogenului conţinut în
moleculele organice ale substratului de către oxigenul atmosferic cu formare
de apă şi eliberare de energie.
Oxidarea și
reducerea sunt două tipuri de reacții chimice , care de multe ori lucrează
împreună. Reacțiile de oxidare și de reducere implică un schimb de electroni
între reactanți.
Care este
diferența dintre oxidare și de reducere?
Oxidarea are loc
atunci când un reactant pierde
electroni în timpul reacției.
Reducerea are
loc atunci când un reactant câștigă
electroni în timpul reacției. Acest lucru se întâmplă adesea când metalele
reacționează cu acid.
Cum
reținem cele două procese? „LEO leul spune
GER“
L ose E lectrons în O xidation.
G ain E lectrons în R eduction.
Exemplu
Reacția
dintre hidrogen și fluor este un exemplu de o reacție de oxidare-reducere:
H20
+ F20→ 2H+1 F-1
Reacția
generală poate fi scrisă ca două jumătăți de reacții :
H 2
→ 2 H + + 2 e - (R.O., A.R.)
F 2
+ 2 e - → 2 F - (R.R., A.O.)
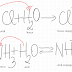
Alte exemple:
Importanța reacții redox
Reacțiile
de oxido-reducere sunt vitale pentru reacții biochimice și procese industriale.
Sistemul de transfer de electroni in celule si oxidarea glucozei in corpul uman
sunt exemple de reacții redox. Reacțiile redox sunt folosite pentru reducerea
minereurilor pentru obținerea metalelor, pentru a produce celule
electrochimice, pentru a transforma amoniacul în acid azotic pentru
îngrășăminte.

Niciun comentariu:
Trimiteți un comentariu