Definiţie
Bazele sunt compuşi anorganici ce conţin în compoziţia lor ioni pozitivi de metal şi ioni negativi hidroxid (HO-).
Exemple: NaOH, KOH, Ca(OH)2, Al(OH)3.
Formula generală a bazelor este Me(OH)n, unde n este valenţa metalului.
Clasificare
Bazele
pot fi clasificate după solubilitatea lor în apă, astfel:
- Baze
solubile, care se dizolvă în apă, cum ar fi NaOH, KOH, Ba(OH)2;
- Baze
insolubile, care nu se dizolvă în apă, de exemplu , Zn(OH)2,
Fe(OH)3, Al(OH)3.
Denumire
Bazele se
denumesc după regula: hidroxid + de + numele
metalului
Dacă metalul din
bază are mai multe valenţe, atunci după numele acestuia se indică în paranteză
şi valenţa acestuia, cu cifre romane: hidroxid + de
+ numele metalului + (valenţa metalului)
Exemple:
Formula chimică
|
Denumirea
|
Formula chimică
|
Denumirea
|
NaOH
|
hidroxid
de sodiu
|
Fe(OH)2
|
hidroxid
de fier (II)
|
KOH
|
hidroxid
de potasiu
|
Fe(OH)3
|
hidroxid
de fier (III)
|
Ca(OH)2
|
hidroxid
de calciu
|
Pb(OH)2
|
hidroxid
de plumb (II)
|
Al(OH)3
|
hidroxid
de aluminiu
|
Pb(OH)4
|
hidroxid
de plumb (IV)
|
1. Stare de agregare - La
temperatură obişnuită bazele sunt substanţe solide albe sau colorate.
NaOH,
KOH, Ca(OH)2, Al(OH)3, Zn(OH)2 - sunt baze de
culoare albă
Fe(OH)3 - brun-roşcat;
Cu(OH)2 - albastru;
Ni(OH)2 - verde.
2.
Punctele de topire ale bazelor sunt foarte ridicate, iar multe baze se
descompun prin încălzire. De exemplu hidroxidul de bariu se topeşte la +408 oC,
iar hidroxidul de sodiu se topeşte la +322 oC.
3.
Solubilitatea bazelor în apă variază în limite largi.
-
NaOH şi KOH sunt uşor solubile în apă;
-
Ca(OH)2, Mg(OH)2,
Ba(OH)2
sunt puţin solubile în apă;
-
Cu(OH)2, Fe(OH)2, Zn(OH)2, Al(OH)3 sunt insolubile în apă.
Soluţiile
apoase ale bazelor uşor solubile sunt leşioase (lunecoase la pipăit) şi
caustice (produc arsuri).
Soluţiile
apoase ale bazelor conduc curentul electric.
Proprietăţi chimice
1.
Acţiunea asupra indicatorilor acido-bazici
La
dizolvare în apă formează ioni hidroxid cu formula HO-. În prezenţa
acestor ioni, indicatorii acido-bazici se colorează diferit.
În
mediu bazic culorile celor mai utilizaţi indicatori sunt:
Indicator
|
Culoare
|
turnesol
|
albastru
|
metiloranj
|
galben
|
fenolftaleină
|
roşu-violet
|
Bazele
solubile reacţionează cu oxizii nemetalici după schema generală:
bază + oxid acid → sare + apă
Exemple:
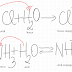
Ca(OH)2
+ SO3 → CaSO4 + H2O
2
NaOH + CO2 → Na2CO3 + H2O
Observaţie:
-
Metalul are în sare aceeaşi valenţă ca şi în bază.
3.
Reacţia cu acizii (Reacţia de neutralizare)
Bazele
reacţionează cu acizii după schema generală:
acid + bază → sare + apă
Exemple:
H2SO4
+ Fe(OH)2 → FeSO4 + 2 H2O
HCl
+ NaOH → NaCl + H2O
Observaţie:
-
Metalul are în sare aceeaşi valenţă ca şi în bază.
4.
Reacţia bazelor solubile cu unele săruri
Bazele
solubile reacţionează cu sărurile solubile ale metalelor care formează baze
insolubile după schema generală:
bază solubilă + sare 1 → sare 2 + bază insolubilă
Exemple:
2
NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
3
KOH + AlCl3 → 3 KCl + Al(OH)3↓
5.
Reacţia de descompunere a unor baze
Multe
baze insolubile şi unele baze solubile suferă reacţii de descompunere la
încălzire, cu formare de oxizi:
Cu(OH)2 → CuO
+ H2O↑
2 Al(OH)3 → Al2O3 + 3 H2O↑
2 Al(OH)3 → Al2O3 + 3 H2O↑
Ca(OH)2 → CaO
+ H2O
Utilizări
În
laborator bazele se folosesc pentru neutralizarea şi dozarea acizilor, şi în
procesele de sinteză a bazelor insolubile şi a sărurilor.
NaOH
se mai poate utiliza la obţinerea săpunurilor şi a detergenţilor, la rafinarea
produselor petroliere etc.
Hidroxidul
de calciu (var stins) se utilizează în construcţii la obţinerea mortarului, la
zugrăvit, la rafinarea zahărului, sau pentru identificarea CO2 în
laborator.
Niciun comentariu:
Trimiteți un comentariu