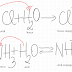
joi, 28 mai 2020
luni, 25 mai 2020
sâmbătă, 23 mai 2020
marți, 19 mai 2020
joi, 14 mai 2020
marți, 12 mai 2020
joi, 7 mai 2020
FORMULE CHIMICE

Întâlnim
substanțe chimice în fiecare zi: alimentele, produsele de igienă, substanțele
de sub chiuveta de bucătărie pe care le folosim pentru curățare, substanțe
pentru zugrăvit, pictură etc. Aceste produse sunt alcătuite din una sau mai
multe substanțe.
O substanță
pură are proprietăți constante, determinate de o compoziție constantă.
Din acest
motiv, pentru fiecare substanță pură există o formulă chimică care arată
compoziția substanței respective.
Pentru
scrierea prescurtată a moleculelor s-au utilizat simbolurile chimice ale
elementelor componente și indici care arată numărul atomilor fiecărui element
din molecula respectivă.



Formula
chimică are o dublă semnificație:
• Calitativă –
indică tipul atomilor componenți.
• Cantitativă
– la
scară macroscopică: un mol de substanță.

Întâlnim substanțe chimice în fiecare zi: alimentele, produsele de igienă, substanțele de sub chiuveta de bucătărie pe care le folosim pentru curățare, substanțe pentru zugrăvit, pictură etc. Aceste produse sunt alcătuite din una sau mai multe substanțe.
O substanță pură are proprietăți constante, determinate de o compoziție constantă.
Din acest motiv, pentru fiecare substanță pură există o formulă chimică care arată compoziția substanței respective.
Pentru scrierea prescurtată a moleculelor s-au utilizat simbolurile chimice ale elementelor componente și indici care arată numărul atomilor fiecărui element din molecula respectivă.



• Cantitativă
– la scară macroscopică: un mol de substanță.
– la scară microscopică: o moleculă de apă (H2O) formată din 2 atomi de H și un atom de O, un atom (Ne) sau o pereche de ioni (Na+ Cl–) de substanță;
Semnificația notației chimice:
2Cl2 : - 2 molecule
de clor 2 =
coeficient - 2 ∙ 2 = 4 atomi de clor 2 = indiceFormula
chimică a unei substanțe care are în compoziție un singur element chimic și cel
puțin doi atomi ai acestuia este Xn, unde X este simbolul chimic al
elementului respectiv, iar indicele n reprezintă numărul de atomi din moleculă.Formula chimică a
unei substanțe simple (conține atomi de același fel)Nemetale: a. monoatomice:
C, Si, S, He, Ne, Ar, Xe, Rn, Kr.b. cu molecule diatomice: H2,
O2, N2, Cl2, Br2, I2c. cu molecule poliatomice: O3,
P4, S8.Formula
chimică a unei substanțe compuse (conține atomi ai unor elemente diferite)a) Compușii
binari sunt
formați din două elemente diferite. Valența fiecărui element chimic din
compoziția substanței devine indice pentru celălalt element.Pentru
stabilirea formulei chimice a unei substanțe formate din două elemente chimice,
trebuie respectate etapele:1.Se scriu simbolurile elementelor componente (metalele se scriu
întotdeauna primele)2.In colțul din dreapta sus al simbolului fiecărui element se scrie
valența elementului, cu cifre romane.3. Se scriu indicii elementelor cu cifre arabe, astfel încât valența
unui element devine indice pentru celălalt element. Indicele 1 nu se scrie.4. In cazul în care indicii au un divizor comun, se simplifică cu acel
divizor și se scriu rezultatele. b) Compușii
ternari sunt
alcătuiți din trei elemente diferite. Aceștia sunt formați din ioni metalici și
ioni poliatomici sau pot fi compuși moleculari H2SO4.Pentru
stabilirea formulei, se aplică același algoritm.Valența ionului
poliatomic = numărul de sarcini.Exemple:• Formula chimică a
oxidului de calciu, CaO, reprezintă perechi de ioni Ca2+ O2-.Există și substanțe
care au în compoziție mai multe elemente chimice:- NaOH - hidroxid de
sodiu- H2SO4
- acid sulfuric- HNO3 -
acid azotic- KNO3 - azotat
de potasiuMetale: K, Na, Al, Fe,
Cu, Ag, Zn etc.Pentru compușii ionici formula chimică nu reprezintă molecule, ci
perechi de ioni.• Formula chimică a
clorurii de sodiu, NaCl, reprezintă perechi de ioni Na+Cl-.
CONCLUZIEFormula chimică este notația
prescurtată a unei substanțe cu ajutorul simbolurilor chimice și a indicilor.Indicele este cifra care
reprezintă numărul atomilor. Se scrie în dreapta jos.Coeficientul este scris în
fața formulei și poate fi interpretat la nivel microscopic sau la nivel
macroscopic.
miercuri, 6 mai 2020
TEST 15 - antrenament BAC chimie anorganică 2020
Subiectul I
Subiectul A
1. A
2. F (Un atom este
neutru din punct de vedere electric adică p+ =e -.Ionii pozitivi se formează prin cedare
de electroni, deci p+>e-)
3. F (Acizii în soluţie apoasă cedează protoni)
4. F (Izotopii au acelaşi Z dar A/număr de neutroni diferit)
5. F (Caracterul nemetalic creste in ordinea
I<Br<Cl<F, nemetalul mai puternic scoate nemetalul mai slab din sarea
lui)
Subiectul B
1. b. 13p+, 13e- , 1s22s22p63s23p1
, ultimul substrat este 3p.
2. d. 11Na, 1s22s22p63s1,
Na∙ →Na+ +1e-; Na0 →Na+1 +1e-,
R.O.
Na+ : 11p+, 10e-
3. d. Anodul (-):
Zn0 →Zn2+ +2e-,
Catodul (+):
Cu2+ +2e-→Cu0
4. c. Reacţia dintre un acid şi o bază= reacţie de neutralizare
5. c. Cl2 + H2O →HClO +HCl; acid +
turnesol=roşu
Subiectul
Coloana A coresunde bazelor care acceptă H+ formând
acizi conjugaţi (coloana B)
1. f; 2.
d; 3. c; 4. a; 5. e.
Subiectul al II-lea
Subiectul D
1. ZKr =36
Ionul pe
care îl formează atomul E este pozitiv monovalent (are cu 1 electron mai putin
decât numărul protonilor) este izolectronic cu Kr.
E∙ → E+
+
1e-
37 e- 36e-,
48n0
37 p+
A=Z+n0
⇒ A= 37+48 ⇒A=86
2. a. 1s22s22p63s23p1
, 5 substraturi şi unul monoelectronic (3p1)
b. 3 electroni pe ultimul strat ⇒grupa IIIA (13a)
3straturi ⇒perioada a 3-a
c. 3p1 ⇒ blocul p
3. a. 11Na, 1s22s22p63s1 , 1e-<4⇒cedează 1e-⇒formează ion pozitiv monovalent
17Cl, 1s22s22p63s23p5 , 7e->4⇒acceptă 1e-⇒formează ion negative monovalent
b. legătură ionică
4.
4. 5. Creşterea
temperaturii si agitarea componentelor favorizează dizolvarea soubstantelor
solide în apă.
Subiectul E
1. a. …H+1Cl+5O-23
+ ...H+12S+4 O-23 → ...H+12S+6 O-24
+ ...H+1Cl-1
Cl+5
+ 6e- → Cl-1 (NO↓, R.R, A.O)
S+4
→ S+6 + 2e- (NO↑,
R.O, A.R) /∙ 3
b. Agent
oxidant : HClO3
2. H+1Cl+5O-23 + 3H+12S+4 O-23
→ 3H+12S+6 O-24
+ H+1Cl-1
3. md
= 32,8 g H2SO3 ⇒ n=m/M ⇒n=32,8/82⇒n=0,4 moli H2SO3
Vs
= 800 mL = 0,8 L
cm = ?
cm
= n / Vs ⇒ cm = 0,4 / 0,8 ⇒ cm = 05 M
4. a. 2HCl
+ 2NaOH → NaCl + NaClO + H2O
b. ms = 100 g HCl, cp
= 18,25%
ms = 300 g NaOH, cp = 4%
mNaCl = ?
40 g 58,5 g
HCl
+ NaOH → NaCl + H2O MHCl = 36,5 g/mol
12 g x g MNaOH = 40
g/mol
cp = md∙10/ms
⇒md = cp ∙ ms / 100
mdHCl=
18,25∙100 / 100 ⇒ mdHCl= 18,25 g
mdNaOH=
4 ∙300 / 100 ⇒ mdNaOH= 12 g
Se
determină excesul de bază sau de acid.
36,5:40 =
0,9125 (referinţa)
18,25 :
12 = 1,52 >0,9125 ⇒HCl este în exces
x = 17,55 g NaCl
5. Anodul
este un grătar de plumb ale cărui ochiuri sunt umplute cu plumb spongios (Pbs).
Catodul
este un grătar de plumb ale cărui ochiuri sunt umplute cu dioxid de plumb (PbO2).
Electrolitul
este o soluţie de H2SO4 cu ρ=1,29 g/cm3 şi c=38% pentru
acumulatorul încărcat.
Subiectul al III-lea
Subiectul F
1. a. C3H8O3(l) + 7/2O2(g)
→ 3CO2(g) + 4H2O(l) + 1652,9 kJ
Reactanţi →Produşi +Q; reactie exotermă, ∆H<0
∆rH =
-1652,9 kJ
b. reacţie exotermă
c. ∆fH0CO2(g) = -
393,5 kL/mol; ∆fH0H2O(l) = - 285,5 kL/mol; ∆fH0O2(g)
= 0
∆rH =( 3∆fH0CO2(g)
+ 4∆fH0H2O(l) ) – ( ∆fH0C3H8O3(l)
+ 7/2 ∆fH0O2(g) )
∆rH =[ 3 (-393,5) +4(-285,5) ] – [∆fH0C3H8O3(l)
+ 7/2∙0]
∆rH =-
669,6 kJ
2. m=9,2 g C3H8O3
Q=?
∆rH = -1652,9 kJ⇒ Q = 1652,9 kJ pentru 1 mol de C3H8O3
n=m/M⇒n=9,2/92 ⇒n=0,1 moli C3H8O3
M C3H8O3 = 92 g/mol
1 mol de C3H8O3 …………1652,9
kJ
0,1 mol de C3H8O3 …………x
kJ
x = 165,29 kJ
3. V=600 mL HCl = 0,6 L HCl
Q = 54979,2 J = 54,9792 kJ
Qneutralizare = 57,27 kJ/mol
cmHCl = ?
1 mol HCl ………………..57,27 kJ
x moli HCl………………..54,9792 kJ
x = 0,96 moli HCl
cm = n/V ⇒ cm = 0,96/0,6 ⇒ cm = 1,6 M
4. Se aplică lehea lui Hess.
∆fH0C4H10(g) = ∆rH01
- ∆rH02 +4∆rH03
+ 4∆rH04
5. C(s) + 2S(s) +
87,9 kJ → CS2(l)
Reactanţi + Q → Produşi ; reacţie endotermă
Subiectul G
1. V2O5 este catalizator
2. VO2 =?, t=270C, p=3 atm
V=0,224 m3 SO2 (c.n.) = 224 L
2∙22,4L 1 mol
2SO2(g)
+ O2(g) ⎯⎯⎯→ 2SO3(g)
224L x moli
x = 5 moli O2
T=27+273=300K
Aplicăm pentru O2 : p∙V=n∙R∙T⇒3∙V=5∙0,082∙300 ⇒V=41 L O2.
3. a. Numărul de molecule se calculează cu relaţia: N=n∙NA
12,044 ∙1023 = n∙6,022 ∙1023
n= 2 moli SO2
n=V/22,4 ⇒V=n∙22,4 ⇒V= 2∙22,4 ⇒V=44,8L SO2
b. m=1,6 Kg SO3 = 1600 g
mS =?
MSO3 = 32+3∙16=80 g/mol
80 g SO3 ………………..32 g S
1600 g SO3 ……………..x g S
x= 640 g S
4. A → Produşi
(1)v= k∙ [A]nA
(2)9∙v = k∙ [3A]nA
Se face raportul (1):(2)⇒1/3=1/3nA ⇒nA = 1
5. a. Zn0 + Cu2+ →Zn2+ + Cu0
b. puntea de sare realizează contactul electric între
cele două soluții şi asigură neutralitatea
soluțiilor.
marți, 5 mai 2020
TEST1 - antrenament BAC chimie anorganică 2020
Subiectul
I
Subiectul
A
1. A ( Izotopii sunt speciile de atomi care au același Z (p+) și A diferit)
2. F
3.
A
(Caracterul metalic se repetă după un anumit număr de elemente)
4.
A
(Reacția dintre Na si apă are loc cu degajare de H2, deci este
reacție rapidă)
5.
A
(Dacă acidul este tare, baza lui conjugată este slabă)
Subiectul B
1. c. 714N ⇒7p+, 7e-, 14-7=7n0, 14 nucleoni, 1s22s22p3, 3 orbitali monoelectronici, 3 substraturi
919 F ⇒9p+,
9e-, 19-9=10n0, 19 nucleoni, 1s22s22p5,
2 orbitali monoelectronici, 3 substraturi
2.
b. CCl4
este solvent nepolar, dizolvă doar compuși nepolari – I2
3.
b. La
electroliza: anodul (+) – R.O. iar catodul (-) – R.R.
NaCl(s)→Na+ +
Cl-
A(+) Cl- →Cl0 + 1e-,
Cl0 + Cl0 → Cl2
C(-)
Na+ +1e- →Na0
4.
b. HCl + NaOH =
NaCl + H2O
acid + bază = neutralizare (reacție rapidă,
exotermă, cu transfer de protoni)
5.
b. [Cu(NH3)4](OH)2
Cu+2 – ion metalic
central, N.C. = 4, sarcina ionului complex [Cu(NH3)4] =
+2, ligand=NH3
Subiectul C
1.
11Na⇒11 e-, 1s2222p63s1,
1 e- de valență, cedează 1e- și formează ioni pozitivi
(cationi) monovalenți
2.
13Al⇒13 e-, 1s2222p63s23p1,
3 e- de valență, cedează 3e- și formează ioni pozitivi
(cationi) trivalenți
3.
8O⇒8 e-,8 p+,
1s2222p4, 6 e- de valență, acceptă
2e- și formează ioni negativi (anioni) divalenți
4.
2He ⇒2 e-,2 p+,
1s2, 2 e- de valență, structură stabilă de dublet
5.
7N⇒ 7 e-, 7p+,
1s2222p3, 5 e- de valență, acceptă
3e- și formează ioni negativi (anioni) trivalenți
1-d
2-f
3-b
4-c
5-e
Subiectul al II-lea
Subiectul D
1.
46106 Pd ⇒ 46 p+,
106-46=60 n0
2.
a.
4 orbitali ocupati cu electroni ⇒1s22s22p2
b. 4 electroni pe ultimul strat ⇒ grupa IV A (14a)
2 straturi ocupate cu electroni ⇒poada a2-a
3.
a.
3Li ⇒3e-,
1s22s1, Li∙→Li+ + 1e-
b. cedând 1 electron se formează un ion
pozitiv, are caracter metalic
4. a. 17Cl⇒1s2222p63s23p5,
7 e- de valență.
5. Solubilitatea CO2 în
apă creste cu creșterea presiunii si cu scăderea temperaturii.
Subiectul E
1.
…K+1N+5O-23 + ...Fe0 → …Fe+32O-23
+ ...N20
+ …K+12O-2
a.
2N+5 +
10e- → N20
(NO↑, R.R, A.O) / ∙3
2Fe0 → Fe+32 + 6e-
(NO↓, R.O, A.R) / ∙5
b.
KNO3
– agent oxidant
2.
6K+1N+5O-23 + 10Fe0 → 5Fe+32O-23
+ 3N20
+ 3K+12O-2
3.
ms1=50
g, cp1 = 10%
ms2, cp2 = 80%
msf, cpf = 20%
msf =?
Se aplică regula dreptunghiului.
ms1:
ms2
= 40:10 = 4:1 ⇒ ms1= 4 ms2 ⇒50 = 4 ms2⇒ ms2=
12,5 g
ms1+ ms2
= msf ⇒ msf
= 50 + 12,5 ⇒ msf = 62,5 g soluție
4.
a.
Zn + CuSO4→ZnSO4
+ Cu↓
b. mplăcuță = 10 g
mCu = 1,6 g
% Zn transformat=?
65g 64 g
Zn + CuSO4 → ZnSO4 + Cu↓
x g
1,6 g
x= 65 ∙1,6 /64 = 1,625 g Zn transformat
10 g plăcuță.................1,625 g Zn
s-a transformat
100 g plăcuță.................y g Zn s-a transformat
y =
16,25 % Zn s-a transformat
5.
a.
Elementul galvanic a cărui funcționare se bazează pe reacția dintre zinc și
sulfatul de cupru este pila Daniel.
b. Zn este anodul pilei (polul negativ la nivelul căruia are loc reacția de oxidare)
Subiectul al
III-lea
Subiectul F
1. C2H4(g) + 6F2(g) →
2CF4(g) + 4HF(g), ∆rH0
∆fH0CF4(g) = - 680
kJ/ mol, ∆fH0C2H4(g) = 52 kJ/ mol, ∆fH0HF(g)
= - 273 kJ/ mol
∆rH0 =( 2∆fH0CF4(g)
+ 4∆fH0HF(g) ) – (∆fH0C2H4(g)
+ 6 ∆fH0F2(g))
∆rH0 =( 2 ∙ (-680) + 4 ∙ (-273)) – (52 + 6 ∙0)
∆rH0 =-1360-1092- 52
∆rH0
= - 2504kJ
2.
∆rH0
= Q
Q = 2504 kJ pentru 4 moli de HF
4 moli HF...............2504 kJ
x moli HF..............12520kJ⇒ x = 20 moli HF
3.
mapă
= 35 Kg
ti = 100C
tf = 600C
capă = 4,18 kJ·kg-1·K-1
Q =?
Q = m∙c∙∆T
Q = 35 ∙ 4,18 ∙50
Q
= 7315 kJ
4.
N2(g)
+ 5/2O2(g) → N2O5 (g), ∆rH0
(1) 4NO2(g) + O2(g)
→ 2 N2O5 (g) + 110 kJ
⇒∆rH1
= - 110 kJ (reacție exotermă)
(2) N2(g) + O2(g)
→ 2NO(g) – 180,5 kJ ⇒∆rH2
= 180,5 kJ(reacție endotermă)
(3) 2NO(g) + O2(g) → 2NO2(g)
+ 114,5 kJ⇒∆rH3
= - 114,5 kJ(reacție exotermă)
Se aplică legea lui Hess.
∆rH0 = ½ ∙∆rH1
+ ∆rH2 + ∆rH3
∆rH0 = ½ ∙ (-110)
+ 180,5 + (-114,5)
∆rH0
= 11 kJ
5.
O
substanță este cu atât mai stabilă cu cât entalpia standard de formare este mai
mică.
c<a<b
Subiectul G
1.
Cl-(aq)
+ AgNO3(aq) → AgCl(s) + 3NO-
(aq)
Reacția este rapidă deoarece are loc cu formarea precipitatului AgCl,
alb brânzos.
2.
mHCl =
14,6 g⇒ n=m/M ⇒n=14,6/36,6 ⇒n =0,4 moli HCl
t = 1270C ⇒T = 127+273⇒T=400K
V= 4,1 L
p=?
p∙V=n∙R∙T
p∙4.1=0,4 ∙0,082∙400⇒p=3,2 atm
3.
a.
n= 0,3Kmoli SO3 = 300 moli
nr. atomi de O = ?
1 mol SO3........................3∙NA
atomi O
300 moli SO3...................x
atomi O
x= 900
∙ NA atomi O
b. V = 4,48 L SO2⇒n=V/22,4 ⇒n=4,48/22,4 ⇒n=0,2 moli
mS =?
1 mol SO2…………….32 g S
0,2 moli SO2…………..x g S
x = 6,4 g S
4.
A
+ B → Produși
(1)
v=
k ∙ [A]nA ∙ [B]nB
(2)
2v=
k ∙ [A]nA ∙ [2B]nB
(3)
16v=
k ∙ [2A]nA ∙ [2B]nB
Pentru a determina nB se face raportul (1):(2)⇒1/2=1/2nB ⇒nB = 1
Pentru a determina nA se face raportul (2):(3)⇒2/16=1/2nA ⇒nA = 3
5.
V
= 400 mL HCl = 0,4 L
m = 1,46 g HCl ⇒n=m/M ⇒n=1,46/36,5 ⇒n = 0,04 moli
HCl
pH=?
HCl este acid tare ⇒cM= [H3O+]=10-pH
cM= n/V(L)⇒ cM=
0,04/0,4⇒ cM=0,1
M
pH
= 1
Test admitere medicina Hidrocarburi alifatice
https://quizizz.com/admin/quiz/601b9047d0ceaf001b7c9f21
-
1. Identificați formulele moleculare și structurale ale următorilor alcooli: a. Alcoolul monohidroxilic saturat secundar conține 60%C; ...
-
Reacţiile acido-bazice Reacţiile cu schimb de protoni se numesc protolitice . De la cele mai mici particule până la cele mai complexe co...
-
Cu excepția atomilor gazelor rare (nobile), atomii celorlalte elemente chimice nu sunt stabili în stare liberă. Ei se unesc pentru a do...