Reacţiile cu schimb de protoni se numesc protolitice.
De la cele mai mici particule până la cele mai complexe combinații, natura din jurul nostru poate fi ”descompusă” și înțeleasă cu ajutorul chimiei.
Acizii și bazele sunt două clase de compuși extrem de importante în intreaga chimie.
Reactții acido-bazice întâlnim în viața de toate zilele, în industrie sau în laborator, în procesele biochimice, etc. Acești compuși au fost identificați încă din cele mai vechi timpuri.
Reactții acido-bazice întâlnim în viața de toate zilele, în industrie sau în laborator, în procesele biochimice, etc. Acești compuși au fost identificați încă din cele mai vechi timpuri.
Teorii, definiții ale acestor compuși au fost date de către S. Arrhenius, de J. Bronsted si T.M. Lowry.
ACIZI
Acizii sunt substanțe compuse formate din unul sau mai multi atomi de hidrogen alături de un radical acid.
Radicalul acid
Atomul sau grupul de atomi care intra in compoziția moleculelor acizilor si care in reacțiile chimice raman neschimbați, se numesc radicali acizi.
- FI (fluorură)
-ClI (clorură)
- BrI (bromură)
-II (iodură)
- SII (sulfură)
- SO4II (sulfat)
- SO3II (sulfit)
- NO3I (azotat)
- NO2I (azotit)
- CO3II (carbonat)
- PO4III (fosfat)
- PO3III (fosfit)
- BrI (bromură)
-II (iodură)
- SII (sulfură)
- SO4II (sulfat)
- SO3II (sulfit)
- NO3I (azotat)
- NO2I (azotit)
- CO3II (carbonat)
- PO4III (fosfat)
- PO3III (fosfit)
Clasificarea acizilor
După compoziție, acizii se clasifica in:
-hidracizi - conțin in molecula lor doar atomi de hidrogen si de nemetal. HCl
-oxiacizi - conțin in molecula lor, pe lângă atomi de hidrogen si nemetal, si atomi de oxigen. H2SO4.
După numărul atomilor de hidrogen, care pot fi înlocuiți cu metale, acizii se impart in 3 grupe:
- acizi monobazici: HCl;
- acizi dibazici: H2SO4;
- acizi tribazici: H3PO4
Denumirea acizilor
Denumirea hidracizilor se formează din termenul acid urmat de numele nemetalului, la care se adaugă sufixul HIDRIC.
Denumirea oxiacizilor in care nemetalul are valența inferioară, se formează din termenul acid urmat de numele nemetalului, la care se adaugă sufixul OS.
Denumirea oxiacizilor in care nemetalul are valența maximă, se formează din termenul acid urmat de numele nemetalului la care se adaugă sufixul IC.
Acid
|
Denumire
|
Radical acid
|
Denumire
|
HCl
|
acid clorhidric
|
Cl-
|
clorură
|
HBr
|
acid bromhidric
|
Br-
|
bromură
|
H2S
|
acid sulfhidric
|
S2-
|
sulfură
|
HS-
|
sulfură acidă
|
Acid
|
Denumire
|
Radical acid
|
Denumire
|
HNO2
|
acid azotos
|
NO2-
|
azotit
|
H2SO3
|
acid sulfuros
|
SO32-
|
sulfit
|
HSO3-
|
sulfit acid
| ||
HNO3
|
acid azotic
|
NO3-
|
azotat
|
H2SO4
|
acid sulfuric
|
SO42-
|
sulfat
|
HSO4-
|
sulfat acid
|
Proprietățile acizilor
Acțiunea acizilor asupra indicatorilor
Acizii înroșesc soluția de turnesol, iar fenolftaleina rămâne incoloră în mediul acid.
Reacția acizilor cu metalele
Acizii reacționează cu unele metale, formând săruri și eliberând hidrogenul.
Acizii reacționează cu unele metale, formând săruri și eliberând hidrogenul.
Zn + 2HCl = ZnCl2 + H2
Reacția acizilor cu oxizii metalici
Acizii reacționează cu oxizii bazici, formând săruri și apa.
Reacția acizilor cu oxizii metalici
Acizii reacționează cu oxizii bazici, formând săruri și apa.
CuO + 2HCl = CuCl2 + H2
Reactia de neutralizare
Acizii reacționează cu bazele, formând săruri și apă, conform reacției generale:
acid + bază = sare + apă.
HCl + NaOH = NaCl + H2O
Reacția acizilor cu sărurile
Din reacțiile acizilor cu sărurile se obțin acizi și săruri noi.
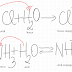
HCl + AgNO3 = AgCl + HNO3
Reactia de neutralizare
Acizii reacționează cu bazele, formând săruri și apă, conform reacției generale:
acid + bază = sare + apă.
HCl + NaOH = NaCl + H2O
Reacția acizilor cu sărurile
Din reacțiile acizilor cu sărurile se obțin acizi și săruri noi.
HCl + AgNO3 = AgCl + HNO3
BAZE
Bazele sunt substanțe compuse în a căror compoziție intră un atom de metal și un număr de grupări hidroxil, egal cu valența metalului.
Clasificarea bazelor
- în funcție de solubilitatea în apă:
■ baze solubile: NaOH
■ baze insolubile: Cu(OH)2.
- în funcție de numărul grupărilor OH:
■ baze monoacide: KOH;
■ baze poliacide : Al(OH)3
- în funcție de culoare:
■ baze albe: Al(OH)3, NaOH;
■ baze colorate : Ni(OH)2 verde, Cu(OH)2 albastru.
Denumirea bazelor
- termenul hidroxid + de + numele metalului.
NaOH hidroxid de sodiu, sodă caustică
- când metalele din compoziția bazelor prezintă valențe variabile, la denumire de adauga si valenta.
Fe(OH)2 hidroxid de Fe(II)
Fe(OH)3 hidroxid de Fe(III)
Proprietati chimice
Actiunea bazelor asupra indicatorilor
Toate bazele solubile albastresc turnesolul si inrosesc fenolftaleina, proprietati folosite la identificarea bazelor.
Reactia de neutralizare
Toate bazele reactioneaza cu acizii, formand saruri si apa.
NaOH + HCl = NaCl + H2O
Reactia bazelor cu oxizii acizi
Bazele reactioneaza cu oxizii acizi, formand saruri si apa.
Ca(OH)2+ CO2 = CaCO3↓ + H2O
Reactia bazelor cu sarurile
Bazele solubile reactioneaza cu sarurile si formeaza baze si saruri noi.
2NaOH + FeCl2 = 2NaCl + Fe(OH)2
Teoria protolitică a acizilor și bazelor
- a fost elaborată de Brönsted si Lowry, conform cărora acizii si bazele se denumesc astfel:
Acizii sunt substanțe care în soluție apoasă au capacitatea de a ceda protoni transformându-se în baze conjugate. Bazele sunt substanțe care în soluție apoasă au capacitatea de a accepta protoni transformându-se în acizi conjugați.
Potrivit teoriei Brönsted-Lowry, tăria unui acid/baze este determinată de capacitatea de a ceda protoni.
Cu cât acidul/baza cedează/acceptă mai uşor protonul, acesta este considerat un acid/bază mai tare.
Acizii/bazele tari sunt total sau aproape total ionizați /ionizate în soluție apoasă.
Acizii/bazele slabi/slabe sunt parțial sau puțin ionizați în soluție apoasă.
Acizi tari: HCl, HBr, HI, H2SO4 , HNO3
Acizi slabi: H2CO3, HF, HCN, CH3COOH
În funcție de numărul protonilor cedați, acizii pot fi:
• acizi monoprotici: HCl, HNO3, CH3COOH, etc.
• acizi diprotici: H2S, H2SO4, etc.
• acizi triprotici: H3PO4, etc.
• acizi poliprotici: H4SiO4, etc.
Disocierea acizilor poliprotici
Acidul sulfhidric H2S este un poliacid (diacid), adică conține în moleculă doi atomi de hidrogen, pe care poate să-i cedeze unor molecule de apă, succesiv, generând două baze conjugate. Al doilea proton este cedat mai greu decât primul. Explicația constă în faptul că primul proton este cedat de o moleculă neutră, iar al doilea este cedat de un acid anionic.
Baze tari: NaOH, KOH
Baze slabe: NH3
În funcție de numărul protonilor acceptați, bazele pot fi:
• monoacide : KOH, NH3, Cl-
• poliacide: Ca(OH)2, S2-
Substanţele care pot avea, funcţie de partenerul de reacţie, atât caracter de acid cât şi caracter de bază, prezintă caracter amfiprotic şi se numesc amfoliţi sau substanţe amfotere.
Astfel, aceste substanţe, amfoliţii, se comportă ca acizi faţă de baze, respectivi ca baze faţă de acizi.
Indicatori acido-bazici
Caracterul acido-bazic al unor solutii se determina cu substante care isi schimba culoarea in mediu acid sau bazic, numite indicatori acido-bazici. Schimbarea culorii indicatorilor este determinata de schimbarea structurii lor.
În apa pură, numărul ionilor de hidroniu este egal cu numărul ionilor de hidroxil, adică este egal cu 10-7 mol/L.
pH. pOH.
pH-ul este logaritmul zecimal cu semn schimbat din concentraţia ionilor hidroniu.
Substanţele care pot avea, funcţie de partenerul de reacţie, atât caracter de acid cât şi caracter de bază, prezintă caracter amfiprotic şi se numesc amfoliţi sau substanţe amfotere.
Astfel, aceste substanţe, amfoliţii, se comportă ca acizi faţă de baze, respectivi ca baze faţă de acizi.
Indicatori acido-bazici
Caracterul acido-bazic al unor solutii se determina cu substante care isi schimba culoarea in mediu acid sau bazic, numite indicatori acido-bazici. Schimbarea culorii indicatorilor este determinata de schimbarea structurii lor.
Autoprotoliza apei
Apa este un amfoter acido-bazic, deoarece conform teoriei protolitice, o moleculă de apă poate ceda un proton unei alte molecule de apă, cu rol de bază. Moleculele de apă pot ioniza conform ecuației:
H2O+H2O=OH‾+H3O+]
Kc = [OH‾]•[H3O+]/[H2O]²
Deoarece ionizarea apei este foarte redusă, concentrația în molecule de apă este constantă și poate fi înglobată în Kc.
Deoarece ionizarea apei este foarte redusă, concentrația în molecule de apă este constantă și poate fi înglobată în Kc.
Astfel putem scrie:
Kc•[H2O]² = [OH‾]•[H3O+] = KH2O,
KH2O= produs ionic al apei
KH2O= produs ionic al apei
La temperatura camerei, acest produs are valoarea constantă, 10-14 mol2/L2.
În apa pură, numărul ionilor de hidroniu este egal cu numărul ionilor de hidroxil, adică este egal cu 10-7 mol/L.
pH-ul este logaritmul zecimal cu semn schimbat din concentraţia ionilor hidroniu.
pH = - lg [H3O+] sau
[H3O+] = 10-pH
pH + pOH = 14
Calcularea pH-ului solutiilor apoase de acizi si baze tari
1. Calculaţi pH-ul unei soluţii de HCl de concentratie 0,1M.
HCl – acid tare
CM(HCl) = [H3O+] = 10-pH ⇒ [H3O+]= 10-1
⇒10-pH = 10-1 ⇒pH=1
2. Calculaţi pH-ul unei soluţii de sodă caustică 0,1 M.
NaOH= sodă caustică = bază tare
CM(NaOH) = [HO-] = 10-pOH ⇒[HO-]= 10-1
⇒10-pOH = 10-1 ⇒pOH=1
pH + pOH = 14 ⇒pH = 14-pOH ⇒pH = 14 - 1
⇒pH = 13





Felicitări!
RăspundețiȘtergereMulțumesc!🤗
Ștergere