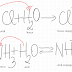
Definiţie
Sărurile
sunt substanţe anorganice care sunt compuse din ioni de metal şi radicali acizi
(sub formă de ioni negativi).
Exemple:
NaCl, K2S, CuSO4, Ca(HSO3)2
Clasificare
Sărurile
se pot clasifica în funcţie de natura radicalului acid în :
a.
Săruri neutre - care conţin radicali acizi neutri (fără
hidrogen), de exemplu: NaCl, K2S, CuSO4;
b.
Săruri acide - care conţin radicali acizi cu caracter
acid (cu hidrogen), de exemplu: Ca(HSO3)2, Na2HPO3,
NaH2PO3, KHS.
Denumire
Sărurile
metalelor cu o singură valenţă se denumesc după regula:
-
denumirea
radicalului acid + de + numele metalului
Dacă
metalul din sare are mai multe valenţe, atunci după numele acestuia se indică
în paranteză şi valenţa acestuia, cu cifre romane:
-
denumirea
radicalului acid + de + numele metalului + (valenţa metalului)
În
unele cazuri pentru denumirea bazelor metalelor cu două valenţe indicarea
valenţei se poate face prin folosirea sufixului "-os" pentru valenţa
inferioară, respectiv "-ic" pentru valenţa superioară.
Exemple:
Formula
chimică
|
Denumirea
|
Formula
chimică
|
Denumirea
|
NaCl
|
clorură de sodiu
|
FeCl2
|
clorură
de fier (II) (feroasă)
|
KHS
|
sulfură acidă de potasiu
|
FeCl3
|
clorură
de fier (III) (ferică)
|
CaCO3
|
carbonat de calciu
|
CuS
|
sulfură
de cupru (II)
|
Al2(SO4)3
|
sulfat de aluminiu
|
Cu2S
|
sulfură
de cupru (I)
|
Stare naturală
Unele
săruri se găsesc în natură în stare solidă în roci sau minereuri:
CaCO3
- calcar;
FeS2
- pirită;
FeCO3
- siderit;
PbS
- galenă;
NaCl
- sare gemă.
Alte
săruri se găsesc dizolvate în apele naturale: Ca(HCO3)2 ,
Mg(HCO3)2 , NaCl, NaBr, KI etc.
Proprietăţi fizice
1. Stare
de agregare
La
temperatură obişnuită, sărurile sunt substanţe solide albe (NaCl, CaCO3,
NaHCO3) sau colorate (AgBr - galben, PbS -negru, PbI2 -
galben)
Sărurile
au puncte de topire ridicate, iar unele săruri se descompun la încălzire.
2.
Solubilitate
Solubilitatea
sărurilor în apă variază în limite largi, unele fiind chiar insolubile în apă
(AgCl, BaSO4 etc).
Unele
săruri, la evaporarea completă a soluţiilor apoase, înglobează în cristalele
lor un anumit număr de molecule de apă formând cristalohidraţi.
(CuSO4.
5 H2O - piatră vânătă, CaSO4. 2 H2O - ghips)
Prin
încălzire cristalohidraţii pierd apa de cristalizare, proces care poate fi
însoţit şi de modificări de culoare.
3.
Conductibilitate electrică
În
stare solidă, sărurile nu conduc curentul electric, dar soluţiile apoase ale
sărurilor solubile conduc curentul electric.
Proprietăţi
chimice
1. Reacţia cu metalele mai active decât metalul din sare
Sărurile
pot reacţiona cu matalele aflate în seria reactivităţii metalelor înaintea
metalului din sare, conform schemei generale:
sare1 + metal mai activ → sare2 + metal mai puţin
activ
CuSO4
+ Fe → FeSO4 + Cu ↓
HgCl2
+ Cu → CuCl2 + Hg↓
2.
Reacţia unor săruri cu bazele solubile
Sărurile
solubile ale metalelor care formează baze insolubile reacţionează cu bazele
solubile după schema generală:
sare1 + bază solubilă → sare2 + bază insolubilă
Exemple:
CuSO4
+ 2 NaOH → Na2SO4 + Cu(OH)2↓(precipitat albastru)
AlCl3
+ 3 KOH → 3 KCl + Al(OH)3↓(precipitat
alb)
NiCl2
+ 2 KOH → 2 KCl + Ni(OH)2↓(precipitat
verde)
Metalele
îşi păstrează valenţa.
3.
Reacţia cu acizii
Sărurile
reacţionează cu acizii mai tari decăt acidul din sare după schema generală:
sare a acidului slab + acid tare → sare a acidului tare + acid slab
Exemple:
CaCO3
+ 2 HCl → CaCl2 + H2O + CO2↑
CuS + H2SO4→
CuSO4 + H2S↑
Dacă
sarea rezultată este insolubilă, atunci tăria acizilor nu mai contează:
AgNO3
+ HCl → HNO3+ AgCl ↓
BaCl2
+ H2SO4→ 2 HCl + BaSO4↓
4.
Reacţia sărurilor solubile între ele
Dacă
prin combinarea ionilor componenţi a două săruri solubile se formează o sare
insolubilă, atunci cele două săruri solubile pot reacţiona între ele:
AgNO3
+ NaCl → NaNO3+ AgCl ↓ (precipitat alb-brânzos, fotosensibil)
BaCl2
+ Na2SO4→ 2 NaCl + BaSO4↓(precipitat alb-lăptos)
5.
Reacţia de descompunere a unor săruri
Unele
săruri se pot descompune prin încălzire cu formare de diferiţi compuşi:
CuCO3
→ CuO
+ CO2 - obţinerea CuO în laborator;
CaCO3
→ CaO
+ CO2 - obţinerea varului nestins (CaO);
NH4HCO3
→ NH3
+ H2O + CO2 - descompunerea prafului de copt;
2
KClO3 → 2
KCl + 3 O2 - obţinerea O2 în laborator;
2
NaNO3 →2
NaNO2 + O2 - obţinerea O2 în laborator;
2
AgNO3 → 2 Ag
+ 2 NO2 + O2
Utilizări
NaCl se
utilizează în alimentaţie şi în obţinerea unor compuşi cum ar fi: clor,
hidrogen, HCl, NaOH.
CaCO3 se foloseşte în construcţii.
Piatra vânătă
(CuSO4. 5 H2O) este utilizată la
tratarea culturilor de viţă de vie şi legume împotriva unor boli.