Nimic mai simplu decât să parcurgeți corect următorii pașii și cu câteva cunoștințe de chimie,veți reuși!
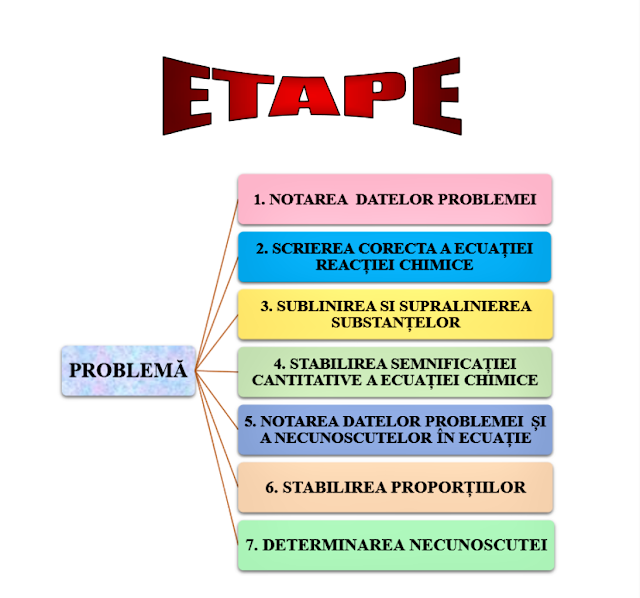
Detalierea etapelor
1. Notarea datelor problemei
Se citește cu atenție enunțul problemei din care desprindem datele problemei, adică ce știm și ce trebuie sa aflăm.
Se fac următoarele notații:
- m = masa de substanță exprimată în kg, g, mg.
- n = numărul de moli exprimat în Kmoli, moli, mmoli.
- V = volumul unui gaz exprimat în, L, mL.
Dacă sunt necesare transformări:
1
Kg=103 g
1g=103
mg
1
g=10-3 Kg
1
mg=10-3 g
|
1
m3=103 L=103 dm3
1
L=1 dm3
1mL=1cm3
1mL=10-3
L
1
L=10-3 m3
|
1Kmol=103
moli
1
mol=103 mmoli
1
mol=10-3 Kmoli
1
mmoli=10-3 mol
|
Ecuaţia reacţiei chimice se desprinde din enunţul problemei.
Câteva elemente ajutătoare:
- Reactia chimică este formată din reactanţi (substanţele simple/compuse care intră în reacţie) şi produşi de reacţie (substanţele simple/compuse care rezultă din reacţie).
- Cele doua părţi componente ale unei reacţii sunt separate prin semnul săgeată →.
Reactanţi → Produşi de reacţie - Este necesară scrierea corectă a formulelor chimice : H2 şi nu H, O2 şi nu O, Mg şi nu Mg2.
- Se stabilesc coeficienţii stoechiometrici = egalarea reacţiei (se aplică legea conservării atomilor pentru fiecare specie în parte).
- Sinteză = obţinere (de exemplu : sinteza apei însemnă că apa va fi produs de reacţie).
3.Sublinierea si supralinierea
substanţelor chimice care intră în calcul
Se vor sublinia şi supralinia doar formulele chimice
care ne intră în calcul (cele care apar în datele problemei).
4. Stabilirea semnificaţiei
cantitative a ecuaţiei chimice
Stabilirea mărimilor cu care se lucrează (moli, g sau
L în condiţii normale).
5. Notarea datelor problemei
şi a necunoscutelor în ecuaţie
Sub formulele chimice subliniate se vor nota datele
problemei însoţite de unitatea de măsură (moli, g, L) şi se stabileşte
necunoscuta (se notează cu x,y sau a,b).
Deasupra formulelor chimice supraliniate se vor nota:
- Coeficientul ∙ M(masa molară) dacă se lucrează în grame;
- Coeficientul (doar atât) dacă se lucrează în moli;
- Coeficientul ∙ 22,4L (Volum molar) dacă se lucrează în litre în c.n.
6. Stabilirea proporţiilor
Proporţiile se
desprind din ecuaţia reacţiei chimice.
7. Determinarea necunoscutei
Din proporţia desprinsă din ecuaţia chimică, se
calculează matematic necunoscuta.
Calculaţi cantitatea de hidrogen exprimată în moli
necesară sintezei din elemente a 5 moli de apă.
1. Notarea
datelor problemei
n
= 5 moli H2O
nH2=
?
2. Scrierea
corectă a ecuţiei reacţiei chimice
H2
+ 1/2O2 →
H2O
3. Sublinierea si supralinierea
substanţelor chimice care intră în calcul
___ ____
H2 + 1/2O2 → H2O
_____ _______
4. Stabilirea semnificaţiei
cantitative a ecuaţiei chimice
Stabilim că vom lucra în moli, întrucât în datele problemei se face referire la cantități exprimate în moli.
5. Notarea datelor problemei
şi a necunoscutelor în ecuaţie
1mol 1 mol
H2 + 1/2O2 → H2O
x moli 5 moli
6. Stabilirea proporţiilor
1 mol H2…………………1 mol H2O
x moli H2……….……….5 moli H2O
7. Determinarea necunoscutei
x = 5 moli H2
H2 + 1/2O2 → H2O
x moli 5 moli
6. Stabilirea proporţiilor
1 mol H2…………………1 mol H2O
x moli H2……….……….5 moli H2O
7. Determinarea necunoscutei
x = 5 moli H2
Exemplu 2:
Calculaţi cantitatea de oxigen (în g şi moli ) care se
obţine la descompunerea a 360 g apă.
m = 360 g H2O
mO2 = ?
nO2 = ?
Stabilim să
lucram în grame şi calculăm masele molare ale substanţelor luate în calcul.
MH2O = 2∙AH + AO =
2∙1 + 16 = 18 g/mol
MO2 = 2∙ AO = 2∙16 = 32 g/mol
18 g 1/2∙32 g
H2O → H2 + 1/2O2
360 g x g
18 g H2O………..1/2∙32 g O2
360 g H2O………..x g O2
x = 320 g O2
Acum transformăm 320 g O2 în moli cu relaţia:
n = m/M ⇒n=320/32⇒n=10 moli O2
Răspuns: 320 g si 10 moli O2.
Niciun comentariu:
Trimiteți un comentariu