1. Definiție
Alcoolii sunt substanţe organice care conţin în molecula lor
grupa hidroxil (-OH) legată de un atom de carbon saturat.
Poliolii conţin în molecula lor mai multe grupe hidroxil
legate de atomi de carbon saturaţi, câte una la un atom de carbon.
2. Denumire
Denumirea
alcoolilor se realizează după una din regulile:
a) denumirea hidrocarburii corespunzătoare + sufixul "-ol":
CH3-OH (metanol)
CH3-CH2-OH (etanol)

b) indice de poziţie care indică
poziţia grupei hidroxil în catenă + denumirea hidrocarburii corespunzătoare +
prefixul care indică numărul grupelor hidroxil (di, tri, tetra, etc.) + sufixul
"-ol":
c) alcool + denumirea
radicalului hidrocarbonat de care se leagă grupa hidroxil + sufixul
"-ic":
CH3-OH (alcool metilic)
CH3-CH2-OH (alcool etilic)
Formula generală a alcoolilor aciclici monohidroxilici saturați: CnH2n+1OH
sau CH2n+2O.
3. Clasificare
4. Izomeri
- Izomeri de catenă, apare la alcoolii cu n ≥ 4.
Exemplu: C4H10
OH
|
|||||||||||
│
|
|||||||||||
CH2
─
|
CH2
─
|
CH2
─
|
CH3
|
CH2─
|
CH─
|
CH3
|
CH3─
|
C─
|
CH3
|
||
│
|
│
|
│
|
│
|
||||||||
OH
|
OH
|
CH3
|
CH3
|
1-butanol
(alcool n-butilic)
|
2-metil-1-propanol
(alcool izobutilic)
|
2-metil-2-propanol
(alcool terțbutilic)
|
- Izomeri de poziție, apare la alcoolii cu
n ≥ 3.
Exemplu: C3H8O
CH2─
|
CH2─
|
CH3
|
CH3─
|
CH─
|
CH3
|
|
│
|
│
|
|||||
OH
|
OH
|
1-propanol
(alcool propilic)
|
2-propanol
(alcool izopropilic)
|
Exemplu: C4H10O
CH2─
|
CH2─
|
CH2─
|
CH3
|
CH3─
|
CH─
|
CH2─
|
CH3
|
|
│
|
│
|
|||||||
OH
|
OH
|
1-butanol
(alcool n-butilic)
|
2-butanol
(alcool sec-butilic)
|
5. Proprietăţi fizice
Moleculele alcoolilor se caracterizează prin prezența legăturilor de hidrogen, reprezentate mai jos
Moleculele alcoolilor se caracterizează prin prezența legăturilor de hidrogen, reprezentate mai jos
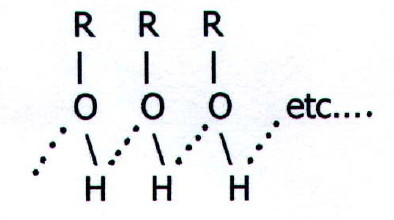
Fiind cele mai puternice interacţiuni intermoleculare, legăturile de hidrogen determină puncte de topire şi de fierbere ridicate. Asa se explică de ce alcoolii au puncte de fierbere ridicate în comparaţie cu punctele de fierbere ale altor compuşi organici cu structuri asemănătoare lor. De exemplu, punctul de fierbere pentru CH3-OH este +64,7˚C, iar punctul de fierbere pentru CH3Cl este -23,7˚C.
La temperatură obişnuită, alcoolii inferiori sunt substanţe lichide.
Alcoolii inferiori sunt substanţe miscibile cu apa, adică se dizolvă în apă în orice proporţie, deoarece între moleculele lor şi moleculele apei se formează legături de hidrogen.
Solubilitatea alcoolilor în apă scade cu mărirea catenei şi creşte cu creşterea numărului de grupe hidroxil.
6. Proprietati chimice
1. Deshidratarea 2-butanolului, este reacția de eliminare a apei, în prezență de acid sulfuric la cald. Eliminarea apei respectă regula lui Zaițev: se elimină grupa hidroxil și hidrogenul de la atomul de carbon cel mai substituit (cel mai sărac).
La temperatură obişnuită, alcoolii inferiori sunt substanţe lichide.
Alcoolii inferiori sunt substanţe miscibile cu apa, adică se dizolvă în apă în orice proporţie, deoarece între moleculele lor şi moleculele apei se formează legături de hidrogen.
Solubilitatea alcoolilor în apă scade cu mărirea catenei şi creşte cu creşterea numărului de grupe hidroxil.
6. Proprietati chimice
1. Deshidratarea 2-butanolului, este reacția de eliminare a apei, în prezență de acid sulfuric la cald. Eliminarea apei respectă regula lui Zaițev: se elimină grupa hidroxil și hidrogenul de la atomul de carbon cel mai substituit (cel mai sărac).
CH3
|
─ CH ─
|
CH2 ─ CH3
|
→CH3─ CH = CH ─ CH3 + H2O
|
|||
│
|
||||||
OH
|
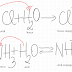
2. Arderea metanolului
(combustia)
Metanolul are putere calorică mare, de aceea poate fi folosit drept combustibil
Metanolul are putere calorică mare, de aceea poate fi folosit drept combustibil
CH3 – OH + 3/2O2 → CO2 + 2H2O |
|


Niciun comentariu:
Trimiteți un comentariu