Zaharidele (glucide,
carbohidrați) sunt compuși naturali sintetizați în plante prin fotosinteză.
nCO2 + nH2 O + energie → CnH2nOn+ nO2
6CO2 + 6H2O + energie → C6H12O6 + 6O2
nC6H12O6 → ─(C6H10O5)n─ + nH2 O
glucoza polizaharidă
Monozaharidele sunt compuși
organici cu funcțiuni mixte care conțin în moleculă o grupă carbonil (aldehidă
sau cetonă) și mai multe grupe hidroxil.
Glucoza și fructoza
Stare naturală. Glucoza și fructoza se găsesc în concentrații mari în fructele dulci și mierea de albine. Glucoza este prezentă și în sânge, limfă, lichidul cefalo-rahidian, în concentrații mici.
Proprietăți fizice
Stare de agregare. Sunt
substanțe solide, cristalizate.
Gust dulce, proprietate care
se intensifică odată cu creșterea numărului de grupe hidroxil din moleculă.
Fructoza este cea mai dulce monozaharidă.
Temperatura de topire este
ridicată deoarece între grupele hidroxil ale monozaharidelor se stabilesc legături
(interacții) de hidrogen.
Solubilitate
Glucoza și fructoza sunt solubile în
apă, parțial solubile în alcool și greu solubile în solvenți organici.
Solubilitatea în apă se explică prin formarea legăturilor de hidrogen între
grupele hidroxil, polare și moleculele de apă (polare).
Formula moleculară, C6H12O6
Glucoza și fructoza au
aceeași formulă moleculară, aceeași compoziție procentuală 40%C, 6,66%H,
53,33%O, aceeași formulă brută CH2O, dar formule de structură diferite. Sunt
izomeri de funcțiune.
Formule structurale
1. Formula structurală (aciclică plană)
Glucoza conține o grupă
carbonil de tip aldehidă, o grupă hidroxil primar și patru grupe hidroxil
secundar (aldohexoză).
Glucoza cu structură
aciclică are patru atomi de carbon asimetrici (chirali), iar 24 = 16 izomeri
optici (enantiomeri, stereoizomeri).
Fructoza cu structură aciclică conține
o grupă carbonil de tip cetonă, două grupe hidroxil primar și trei grupe
hidroxil secundar (cetohexoză).
Are trei atomi de
carbon asimetrici, 23= 8 izomeri optici (enantiomeri, stereoizomeri).
2. Formule (ciclice) de perspectivă Haworth
Glucoza se reprezintă printr-un hexagon regulat perpendicular pe planul
hârtiei, numit ciclu piranozic (5 atomi de carbon și 1 atom de oxigen).
Fructoza se reprezintă printr-un pentagon regulat numit ciclu furanozic
(4 atomi de carbon și 1 atom de oxigen).
În funcție de poziția grupei hidroxil glicozidic, atât glucoza cât și
fructoza se găsesc sub forma a doi stereoizomeri: anomerul α și anomerul β.
- anomerul α –
hidroxilul glicozidic se află de aceeași parte a ciclului hidroxilul de la atomul
de carbon C4.
-
anomerul β– hidroxilul glicozidic este în partea opusă a ciclului
hidroxilul de la atomul de carbon C4.
Proprietăți chimice
1. Reacția de oxidare. Aldozele sunt monozaharide care
pot fi oxidate în prezența unor agenți oxidanți.
Oxidarea glucozei cu reactiv Tollens și Fehling
demonstrează caracterul reducător al glucozei.
Glucoza reduce
ionii de Ag+ din reactivul Tollens, la argint care se depune pe pereții eprubetei, iar ionii de
Cu2+ din reactivul Fehling, la ionii Cu+ din oxidul de cupru
(precipitat roșu-cărămiziu). Aceste reacții sunt
utilizate pentru identificarea glucozei.

Sau folosind formule moleculare:
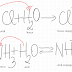
C6H12O6 + 2[Ag(NH3)2]OH → C6H12O7 + 2Ag↓ + 4NH3 + H2O
oglinda de argint
C6H12O6 + 2Cu(OH)2 → C6H12O7 + Cu2O↓ + 2H2 O
precipitat brun
În analizele medicale glucoza se determină cu ajutorul
reactivului Fehling.
Acidul gluconic obținut
se folosește la obținerea gluconatului de calciu.
2. Fermentația alcoolică
a glucozei, în prezența unor
enzime din drojdia de bere, cu formare de alcool etilic și dioxid de carbon.
C6H12O6 → 2CH3─ CH2─OH + 2CO2 ↑
Pe această proprietate
se bazează obținerea băuturilor alcoolice prin fermentarea sucurilor dulci din
fructe.
3. Condensarea monozaharidelor este reacția de eliminare a apei între molecule identice sau diferite de monozaharide.
Prin eliminarea apei între două molecule de monozaharide se obțin dizaharide.
2C6H12O6 → C12H22O11 + H2O
2C6H12O6 → C12H22O11 + H2O
dizaharidă
În funcție de modul de eliminare a apei dizaharidele pot fi:
- Reducătoare, eliminarea apei se face între grupa hidroxil glicozidic al unei molecule și o grupă hidroxil al celeilalte monozaharide. Aceste dizaharide reduc reactivii Tollens și Fehling.
Exemplu: α–glucoză + α–glucoză → maltoză
β –glucoză + β –glucoză → celobioză
- Nereducătoare, eliminarea apei se face între grupele hidroxil glicozidiceale monozaharidelor. Aceste dizaharide nu reduc reactivii Tollens și Fehling.
Exemplu: α–glucoză + β–fructoză → zaharoza
Zaharoza se obține prin eliminarea apei între grupele hidroxil glicozidice ale α–glucozei (α– glucopiranozei) și β–fructozei (β–fructofuranozei).
Utilizări
Glucoza este folosită în medicină, deoarece este un compus ușor asimilabil în organismul uman și un bun furnizor de energie.
C6H12O6 + 6O2 → 6CO2 + 6H2O + Q
Industrial se utilizează la prepararea produselor zaharoase, a gluconatului de calciu, a pastilelor de vitamina C și la fabricarea oglinzilor, obținerea băuturilor alcoolice.
Zaharoza (zahărul)
Este o dizaharidă rezultată prin condensarea unei molecule de α–glucoză și β–fructoză.
C6H12O6 + C6H12O6 → C12H22O11 + H2O
α–glucoză β–fructoză zaharoza
Stare naturală
Se găsește în tulpina trestiei de zahăr și în sfecla de zahăr, plante din care se extrage industrial, dar și în morcovi, pepeni, zmeură, piersici, caise, etc.
Proprietăți fizice Zaharoza este solidă, cristalizată, cu gust dulce. Este solubilă în apă (se realizează legături de hidrogen între grupele hidroxil și moleculele de apă), greu solubilă în alcool și în solvenți organici. Se topește la 185ºC, rezultând caramelul, iar la încălzire avansată se carbonizează.
Utilizare
Zaharoza se folosește în alimentație, având rol energetic în organism (un gram de zahăr eliberează prin oxidare 4,1 kcal). Industrial se utilizează la fabricarea produselor zaharoase și a băuturilor răcoritoare.
C6H12O6 + C6H12O6 → C12H22O11 + H2O
α–glucoză β–fructoză zaharoza
Stare naturală
Se găsește în tulpina trestiei de zahăr și în sfecla de zahăr, plante din care se extrage industrial, dar și în morcovi, pepeni, zmeură, piersici, caise, etc.
Proprietăți fizice Zaharoza este solidă, cristalizată, cu gust dulce. Este solubilă în apă (se realizează legături de hidrogen între grupele hidroxil și moleculele de apă), greu solubilă în alcool și în solvenți organici. Se topește la 185ºC, rezultând caramelul, iar la încălzire avansată se carbonizează.
Utilizare
Zaharoza se folosește în alimentație, având rol energetic în organism (un gram de zahăr eliberează prin oxidare 4,1 kcal). Industrial se utilizează la fabricarea produselor zaharoase și a băuturilor răcoritoare.
Polizaharide
Amidonul
Este o polizaharidă rezultată prin policondensarea α–glucozei. Are rol de rezervă în plante.
Din punct de vedere al compoziției chimice, amidonul este un amestec de două polizaharide: amiloza (20%) reprezintă miezul granulei și amilopectina (80%) învelișul granulei. Amiloza este partea solubilă din amidon, iar amilopectina partea insolubilă.Formula moleculară a amidonului este ─(C6H10O5)n─ , iar structura sa conține unități de α–glucoză.
Este o polizaharidă rezultată prin policondensarea α–glucozei. Are rol de rezervă în plante.
Din punct de vedere al compoziției chimice, amidonul este un amestec de două polizaharide: amiloza (20%) reprezintă miezul granulei și amilopectina (80%) învelișul granulei. Amiloza este partea solubilă din amidon, iar amilopectina partea insolubilă.Formula moleculară a amidonului este ─(C6H10O5)n─ , iar structura sa conține unități de α–glucoză.
Stare naturală
Se găsește sub formă de granule în cereale, cartofi, rădăcinoase, etc.
Proprietăți fizice Amidonul este o pulbere albă, amorfă, fără gust dulce și fără miros. Este insolubil în apă rece, iar la încălzire 50-60ºC, formează o suspensie vâscoasă, lipicioasă, care prin răcire devine un gel, numit cocă (formată din amilopectină).
Proprietăți chimice
Hidroliza enzimatică parțială a amidonului are loc în organism în prezența enzimelor numite amilaze. Amidonul se transformă în dextrine (oligozaharide superioare) și maltoză.
Hidroliza enzimatică totală a amidonului sau hidroliza acidă conduce la α–glucoză.
─(C6H10O5)n─ + nH2O → nC6H12O6
amidon α–glucoză
Identificarea amidonului
În prezența iodului, amidonul se colorează în albastru (compuși de incluziune ai iodului în golurile din structura amidonului). Această reacție se folosește la identificarea amidonului în produse alimentare (smântână, iaurt).
Celuloza nu se colorează în prezența iodului.
Utilizări
Amidonul se utilizează în alimentație sub formă de cartofi, pâine, paste făinoase, budinci, creme.
În organismul omului contribuie la necesarul glucidic, are rol energetic.
În industrie se folosește la obținerea glucozei, alcoolului, apretului, dar și ca agent de îngroșare, aditiv în tablete farmaceutice.
Celuloza
Este cea mai răspândită polizaharidă din natură. Are rol de susținere în plante, asigură plantelor rezistență mecanică și elasticitate.
Formula moleculară este aceeași cu a amidonului, iar în structura sa intră resturi de β–glucoză. ─(C6H10O5)n─ unde n variază între 300 și 3000 în funcție de specia din care provine.
Stare naturală
Celuloza se găsește în bumbac, in, cânepă, lemn, stuf, paie. Cea mai pură celuloză se află în bumbac și se folosește în industria textilă. Celuloza din lemn, stuf, paie este mai puțin pură, iar separarea componentelor necelulozice se face cu ajutorul unor reactivi acizi sau bazici. Celuloza rezultată este folosită la fabricarea hârtiei și fibrelor artificiale.
Proprietăți fizice Celuloza este solidă, amorfă, de culoare albă, insolubilă în apă și în solvenți organici. Insolubilitatea în apă se explică prin formarea legăturilor de hidrogen puternice între grupele hidroxil din macromoleculele celulozei, acestea sunt împachetate foarte strâns și oferă rezistență față de solvenți.
Este solubilă în hidroxid de tetraaminocupru (II), [Cu(NH3)4](OH)2 numit și reactiv Schweitzer. Soluția obținută prin dizolvarea celulozei în reactivul Schweitzer este trecută prin orificii foarte fine (filare umedă) într-o baie cu acid și astfel se obține un tip de mătase artificială.
Nu are gust dulce specific zaharidelor și nu se topește prin încălzire.
Utilizări
Celuloza se folosește în industria textilă, la obținerea hârtiei și a mătăsii artificiale (mătase vâscoză, mătase acetat), a unor materiale pentru bandaj, subtanțe explozive.
Pentru organismul uman, celuloza nu are valoare nutritivă, deoarece în organismul omului nu există enzimele necesare hidrolizei celulozei. Celuloza intră în componența fibrelor alimentare care au efect benefic în digestie.
Proprietăți fizice Amidonul este o pulbere albă, amorfă, fără gust dulce și fără miros. Este insolubil în apă rece, iar la încălzire 50-60ºC, formează o suspensie vâscoasă, lipicioasă, care prin răcire devine un gel, numit cocă (formată din amilopectină).
Proprietăți chimice
Hidroliza enzimatică parțială a amidonului are loc în organism în prezența enzimelor numite amilaze. Amidonul se transformă în dextrine (oligozaharide superioare) și maltoză.
Hidroliza enzimatică totală a amidonului sau hidroliza acidă conduce la α–glucoză.
─(C6H10O5)n─ + nH2O → nC6H12O6
amidon α–glucoză
Identificarea amidonului
În prezența iodului, amidonul se colorează în albastru (compuși de incluziune ai iodului în golurile din structura amidonului). Această reacție se folosește la identificarea amidonului în produse alimentare (smântână, iaurt).
Celuloza nu se colorează în prezența iodului.
Utilizări
Amidonul se utilizează în alimentație sub formă de cartofi, pâine, paste făinoase, budinci, creme.
În organismul omului contribuie la necesarul glucidic, are rol energetic.
În industrie se folosește la obținerea glucozei, alcoolului, apretului, dar și ca agent de îngroșare, aditiv în tablete farmaceutice.
Celuloza
Este cea mai răspândită polizaharidă din natură. Are rol de susținere în plante, asigură plantelor rezistență mecanică și elasticitate.
Formula moleculară este aceeași cu a amidonului, iar în structura sa intră resturi de β–glucoză. ─(C6H10O5)n─ unde n variază între 300 și 3000 în funcție de specia din care provine.
Stare naturală
Celuloza se găsește în bumbac, in, cânepă, lemn, stuf, paie. Cea mai pură celuloză se află în bumbac și se folosește în industria textilă. Celuloza din lemn, stuf, paie este mai puțin pură, iar separarea componentelor necelulozice se face cu ajutorul unor reactivi acizi sau bazici. Celuloza rezultată este folosită la fabricarea hârtiei și fibrelor artificiale.
Proprietăți fizice Celuloza este solidă, amorfă, de culoare albă, insolubilă în apă și în solvenți organici. Insolubilitatea în apă se explică prin formarea legăturilor de hidrogen puternice între grupele hidroxil din macromoleculele celulozei, acestea sunt împachetate foarte strâns și oferă rezistență față de solvenți.
Este solubilă în hidroxid de tetraaminocupru (II), [Cu(NH3)4](OH)2 numit și reactiv Schweitzer. Soluția obținută prin dizolvarea celulozei în reactivul Schweitzer este trecută prin orificii foarte fine (filare umedă) într-o baie cu acid și astfel se obține un tip de mătase artificială.
Nu are gust dulce specific zaharidelor și nu se topește prin încălzire.
Utilizări
Celuloza se folosește în industria textilă, la obținerea hârtiei și a mătăsii artificiale (mătase vâscoză, mătase acetat), a unor materiale pentru bandaj, subtanțe explozive.
Pentru organismul uman, celuloza nu are valoare nutritivă, deoarece în organismul omului nu există enzimele necesare hidrolizei celulozei. Celuloza intră în componența fibrelor alimentare care au efect benefic în digestie.





Niciun comentariu:
Trimiteți un comentariu