Cu excepția atomilor gazelor rare (nobile),
atomii celorlalte elemente chimice nu sunt stabili în stare liberă. Ei se unesc
pentru a dobândi configurația gazului nobil apropiat din Tabelul periodic, fie
prin transfer de electroni de la un atom la altul (cedează - acceptă), cazul
compușilor ionici, fie prin punere în comun de electroni, cazul compușilor
moleculari.
Stabilitatea unui atom este determinată
de configurația electronică a ultimului său strat numit strat de valență.
Capacitatea de combinare a atomului unui
element chimic cu alți atomi se numește valență.
Valența depinde de numărul electronilor
de pe ultimul strat, electronii de valență.
Valența
unui element este dată de numărul electronilor cu care atomul elementului
participă la formarea
compusului. Astfel, un element poate fi monovalent (are valența I), divalent
(are valența II), trivalent (are valența III) etc.
Gazele
rare sunt zerovalente, deoarece atomii lor au configurații stabile pe ultimul
strat.
Aplicație
Utilizează
Tabelul periodic pentru a determina numărul stratului de valență și numărul
electronilor de
valență pentru atomii elementelor chimice Ba, S, C, K.
Valența unui
element chimic este egală cu numărul de electroni din stratul de valență cu
care atomul
elementului respectiv participă la formarea compușilor ionici sau a compușilor
moleculari.
Valența
se notează cu cifre romane sau cu cifre arabe.
Reguli
pentru stabilirea valenței:
Valența
metalelor din grupele principale este egală cu cifra unităților din numărul
grupei.
Spre exemplu, atomul
de sodiu, de magneziu sau cel de aluminiu cedează 1, 2 sau 3 electroni unor
atomi ai nemetalelor pentru a-și asigura configurația stabilă de gaz nobil,
formând compuși ionici. Valența acestora este egală cu I, II sau III. Aceste
metale se află în grupele 1, 2 și 13, deci valența lor (I, II sau III) este
egală cu cifra unităților din numărul grupei.
Metalele din
grupele secundare au
una sau mai multe valențe. Reține valențele unor metale din grupele
secundare: argintul are valența I, zincul are valența II, cuprul are valențele
I și II, fierul are valențele II și III.
Nemetalele, cu
unele excepții, au una sau mai multe valențe. Valența nemetalelor se stabilește
față de hidrogen sau de oxigen.
Valența
nemetalelor în compușii cu hidrogenul (sau cu metalele) este egală cu diferența
dintre 18 și numărul grupei.
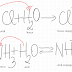
Valențele
elementelor determină formulele chimice, modul de formare și proprietățile
substanțelor.
Prin
urmare, pentru a scrie formula chimică a unui compus este important să aflăm cat
mai ușor valențele elementelor chimice, fără să descriem formarea compusului.
Știm că elementele din grupele principale au numărul electronilor de pe ultimul
strat egal cu cifra unităților din numărul grupei. Numărul electronilor de pe
ultimul strat determină valența unui element chimic.
Deducem că putem afla valențele elementelor din grupele principale
utilizând Tabelul Periodic.
DE REȚINUT!
Elementele din grupele 1a
(IA) şi 2a (IIA) este egală cu numărul grupei, iar elementele din
grupa 13a (IIIA) au valenţa egală cu III.
Elementele din grupele 14a
(IVA), 15a (VA), 16a (VIA) şi 17a (VIIA) au
valenţe variabile. În compuşii cu hidrogenul sau cu metalelele, au valenţa
egală cu 18 - numărul grupei. În compuşii ci oxigenul, pot manifesta mai multe
valenţe. Cea maximă este egală cu numărul grupei – 10 şi apoi pot fi valenţe cu
câte două unităţi mai mici.
Excepţie fac fluorul, care este
constant monovalent şi oxigenul, constant divalent.




Niciun comentariu:
Trimiteți un comentariu