Subiectul
I
Subiectul
A
1. A ( Izotopii sunt speciile de atomi care au același Z (p+) și A diferit)
2. F
3.
A
(Caracterul metalic se repetă după un anumit număr de elemente)
4.
A
(Reacția dintre Na si apă are loc cu degajare de H2, deci este
reacție rapidă)
5.
A
(Dacă acidul este tare, baza lui conjugată este slabă)
Subiectul B
1. c. 714N ⇒7p+, 7e-, 14-7=7n0, 14 nucleoni, 1s22s22p3, 3 orbitali monoelectronici, 3 substraturi
919 F ⇒9p+,
9e-, 19-9=10n0, 19 nucleoni, 1s22s22p5,
2 orbitali monoelectronici, 3 substraturi
2.
b. CCl4
este solvent nepolar, dizolvă doar compuși nepolari – I2
3.
b. La
electroliza: anodul (+) – R.O. iar catodul (-) – R.R.
NaCl(s)→Na+ +
Cl-
A(+) Cl- →Cl0 + 1e-,
Cl0 + Cl0 → Cl2
C(-)
Na+ +1e- →Na0
4.
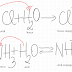
b. HCl + NaOH =
NaCl + H2O
acid + bază = neutralizare (reacție rapidă,
exotermă, cu transfer de protoni)
5.
b. [Cu(NH3)4](OH)2
Cu+2 – ion metalic
central, N.C. = 4, sarcina ionului complex [Cu(NH3)4] =
+2, ligand=NH3
Subiectul C
1.
11Na⇒11 e-, 1s2222p63s1,
1 e- de valență, cedează 1e- și formează ioni pozitivi
(cationi) monovalenți
2.
13Al⇒13 e-, 1s2222p63s23p1,
3 e- de valență, cedează 3e- și formează ioni pozitivi
(cationi) trivalenți
3.
8O⇒8 e-,8 p+,
1s2222p4, 6 e- de valență, acceptă
2e- și formează ioni negativi (anioni) divalenți
4.
2He ⇒2 e-,2 p+,
1s2, 2 e- de valență, structură stabilă de dublet
5.
7N⇒ 7 e-, 7p+,
1s2222p3, 5 e- de valență, acceptă
3e- și formează ioni negativi (anioni) trivalenți
1-d
2-f
3-b
4-c
5-e
Subiectul al II-lea
Subiectul D
1.
46106 Pd ⇒ 46 p+,
106-46=60 n0
2.
a.
4 orbitali ocupati cu electroni ⇒1s22s22p2
b. 4 electroni pe ultimul strat ⇒ grupa IV A (14a)
2 straturi ocupate cu electroni ⇒poada a2-a
3.
a.
3Li ⇒3e-,
1s22s1, Li∙→Li+ + 1e-
b. cedând 1 electron se formează un ion
pozitiv, are caracter metalic
4. a. 17Cl⇒1s2222p63s23p5,
7 e- de valență.
5. Solubilitatea CO2 în
apă creste cu creșterea presiunii si cu scăderea temperaturii.
Subiectul E
1.
…K+1N+5O-23 + ...Fe0 → …Fe+32O-23
+ ...N20
+ …K+12O-2
a.
2N+5 +
10e- → N20
(NO↑, R.R, A.O) / ∙3
2Fe0 → Fe+32 + 6e-
(NO↓, R.O, A.R) / ∙5
b.
KNO3
– agent oxidant
2.
6K+1N+5O-23 + 10Fe0 → 5Fe+32O-23
+ 3N20
+ 3K+12O-2
3.
ms1=50
g, cp1 = 10%
ms2, cp2 = 80%
msf, cpf = 20%
msf =?
Se aplică regula dreptunghiului.
ms1:
ms2
= 40:10 = 4:1 ⇒ ms1= 4 ms2 ⇒50 = 4 ms2⇒ ms2=
12,5 g
ms1+ ms2
= msf ⇒ msf
= 50 + 12,5 ⇒ msf = 62,5 g soluție
4.
a.
Zn + CuSO4→ZnSO4
+ Cu↓
b. mplăcuță = 10 g
mCu = 1,6 g
% Zn transformat=?
65g 64 g
Zn + CuSO4 → ZnSO4 + Cu↓
x g
1,6 g
x= 65 ∙1,6 /64 = 1,625 g Zn transformat
10 g plăcuță.................1,625 g Zn
s-a transformat
100 g plăcuță.................y g Zn s-a transformat
y =
16,25 % Zn s-a transformat
5.
a.
Elementul galvanic a cărui funcționare se bazează pe reacția dintre zinc și
sulfatul de cupru este pila Daniel.
b. Zn este anodul pilei (polul negativ la nivelul căruia are loc reacția de oxidare)
Subiectul al
III-lea
Subiectul F
1. C2H4(g) + 6F2(g) →
2CF4(g) + 4HF(g), ∆rH0
∆fH0CF4(g) = - 680
kJ/ mol, ∆fH0C2H4(g) = 52 kJ/ mol, ∆fH0HF(g)
= - 273 kJ/ mol
∆rH0 =( 2∆fH0CF4(g)
+ 4∆fH0HF(g) ) – (∆fH0C2H4(g)
+ 6 ∆fH0F2(g))
∆rH0 =( 2 ∙ (-680) + 4 ∙ (-273)) – (52 + 6 ∙0)
∆rH0 =-1360-1092- 52
∆rH0
= - 2504kJ
2.
∆rH0
= Q
Q = 2504 kJ pentru 4 moli de HF
4 moli HF...............2504 kJ
x moli HF..............12520kJ⇒ x = 20 moli HF
3.
mapă
= 35 Kg
ti = 100C
tf = 600C
capă = 4,18 kJ·kg-1·K-1
Q =?
Q = m∙c∙∆T
Q = 35 ∙ 4,18 ∙50
Q
= 7315 kJ
4.
N2(g)
+ 5/2O2(g) → N2O5 (g), ∆rH0
(1) 4NO2(g) + O2(g)
→ 2 N2O5 (g) + 110 kJ
⇒∆rH1
= - 110 kJ (reacție exotermă)
(2) N2(g) + O2(g)
→ 2NO(g) – 180,5 kJ ⇒∆rH2
= 180,5 kJ(reacție endotermă)
(3) 2NO(g) + O2(g) → 2NO2(g)
+ 114,5 kJ⇒∆rH3
= - 114,5 kJ(reacție exotermă)
Se aplică legea lui Hess.
∆rH0 = ½ ∙∆rH1
+ ∆rH2 + ∆rH3
∆rH0 = ½ ∙ (-110)
+ 180,5 + (-114,5)
∆rH0
= 11 kJ
5.
O
substanță este cu atât mai stabilă cu cât entalpia standard de formare este mai
mică.
c<a<b
Subiectul G
1.
Cl-(aq)
+ AgNO3(aq) → AgCl(s) + 3NO-
(aq)
Reacția este rapidă deoarece are loc cu formarea precipitatului AgCl,
alb brânzos.
2.
mHCl =
14,6 g⇒ n=m/M ⇒n=14,6/36,6 ⇒n =0,4 moli HCl
t = 1270C ⇒T = 127+273⇒T=400K
V= 4,1 L
p=?
p∙V=n∙R∙T
p∙4.1=0,4 ∙0,082∙400⇒p=3,2 atm
3.
a.
n= 0,3Kmoli SO3 = 300 moli
nr. atomi de O = ?
1 mol SO3........................3∙NA
atomi O
300 moli SO3...................x
atomi O
x= 900
∙ NA atomi O
b. V = 4,48 L SO2⇒n=V/22,4 ⇒n=4,48/22,4 ⇒n=0,2 moli
mS =?
1 mol SO2…………….32 g S
0,2 moli SO2…………..x g S
x = 6,4 g S
4.
A
+ B → Produși
(1)
v=
k ∙ [A]nA ∙ [B]nB
(2)
2v=
k ∙ [A]nA ∙ [2B]nB
(3)
16v=
k ∙ [2A]nA ∙ [2B]nB
Pentru a determina nB se face raportul (1):(2)⇒1/2=1/2nB ⇒nB = 1
Pentru a determina nA se face raportul (2):(3)⇒2/16=1/2nA ⇒nA = 3
5.
V
= 400 mL HCl = 0,4 L
m = 1,46 g HCl ⇒n=m/M ⇒n=1,46/36,5 ⇒n = 0,04 moli
HCl
pH=?
HCl este acid tare ⇒cM= [H3O+]=10-pH
cM= n/V(L)⇒ cM=
0,04/0,4⇒ cM=0,1
M
pH
= 1


Niciun comentariu:
Trimiteți un comentariu