Subiectul I
Subiectul A
1. A
2. F (Un atom este
neutru din punct de vedere electric adică p+ =e -.Ionii pozitivi se formează prin cedare
de electroni, deci p+>e-)
3. F (Acizii în soluţie apoasă cedează protoni)
4. F (Izotopii au acelaşi Z dar A/număr de neutroni diferit)
5. F (Caracterul nemetalic creste in ordinea
I<Br<Cl<F, nemetalul mai puternic scoate nemetalul mai slab din sarea
lui)
Subiectul B
1. b. 13p+, 13e- , 1s22s22p63s23p1
, ultimul substrat este 3p.
2. d. 11Na, 1s22s22p63s1,
Na∙ →Na+ +1e-; Na0 →Na+1 +1e-,
R.O.
Na+ : 11p+, 10e-
3. d. Anodul (-):
Zn0 →Zn2+ +2e-,
Catodul (+):
Cu2+ +2e-→Cu0
4. c. Reacţia dintre un acid şi o bază= reacţie de neutralizare
5. c. Cl2 + H2O →HClO +HCl; acid +
turnesol=roşu
Subiectul
Coloana A coresunde bazelor care acceptă H+ formând
acizi conjugaţi (coloana B)
1. f; 2.
d; 3. c; 4. a; 5. e.
Subiectul al II-lea
Subiectul D
1. ZKr =36
Ionul pe
care îl formează atomul E este pozitiv monovalent (are cu 1 electron mai putin
decât numărul protonilor) este izolectronic cu Kr.
E∙ → E+
+
1e-
37 e- 36e-,
48n0
37 p+
A=Z+n0
⇒ A= 37+48 ⇒A=86
2. a. 1s22s22p63s23p1
, 5 substraturi şi unul monoelectronic (3p1)
b. 3 electroni pe ultimul strat ⇒grupa IIIA (13a)
3straturi ⇒perioada a 3-a
c. 3p1 ⇒ blocul p
3. a. 11Na, 1s22s22p63s1 , 1e-<4⇒cedează 1e-⇒formează ion pozitiv monovalent
17Cl, 1s22s22p63s23p5 , 7e->4⇒acceptă 1e-⇒formează ion negative monovalent
b. legătură ionică
4.
4. 5. Creşterea
temperaturii si agitarea componentelor favorizează dizolvarea soubstantelor
solide în apă.
Subiectul E
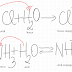
1. a. …H+1Cl+5O-23
+ ...H+12S+4 O-23 → ...H+12S+6 O-24
+ ...H+1Cl-1
Cl+5
+ 6e- → Cl-1 (NO↓, R.R, A.O)
S+4
→ S+6 + 2e- (NO↑,
R.O, A.R) /∙ 3
b. Agent
oxidant : HClO3
2. H+1Cl+5O-23 + 3H+12S+4 O-23
→ 3H+12S+6 O-24
+ H+1Cl-1
3. md
= 32,8 g H2SO3 ⇒ n=m/M ⇒n=32,8/82⇒n=0,4 moli H2SO3
Vs
= 800 mL = 0,8 L
cm = ?
cm
= n / Vs ⇒ cm = 0,4 / 0,8 ⇒ cm = 05 M
4. a. 2HCl
+ 2NaOH → NaCl + NaClO + H2O
b. ms = 100 g HCl, cp
= 18,25%
ms = 300 g NaOH, cp = 4%
mNaCl = ?
40 g 58,5 g
HCl
+ NaOH → NaCl + H2O MHCl = 36,5 g/mol
12 g x g MNaOH = 40
g/mol
cp = md∙10/ms
⇒md = cp ∙ ms / 100
mdHCl=
18,25∙100 / 100 ⇒ mdHCl= 18,25 g
mdNaOH=
4 ∙300 / 100 ⇒ mdNaOH= 12 g
Se
determină excesul de bază sau de acid.
36,5:40 =
0,9125 (referinţa)
18,25 :
12 = 1,52 >0,9125 ⇒HCl este în exces
x = 17,55 g NaCl
5. Anodul
este un grătar de plumb ale cărui ochiuri sunt umplute cu plumb spongios (Pbs).
Catodul
este un grătar de plumb ale cărui ochiuri sunt umplute cu dioxid de plumb (PbO2).
Electrolitul
este o soluţie de H2SO4 cu ρ=1,29 g/cm3 şi c=38% pentru
acumulatorul încărcat.
Subiectul al III-lea
Subiectul F
1. a. C3H8O3(l) + 7/2O2(g)
→ 3CO2(g) + 4H2O(l) + 1652,9 kJ
Reactanţi →Produşi +Q; reactie exotermă, ∆H<0
∆rH =
-1652,9 kJ
b. reacţie exotermă
c. ∆fH0CO2(g) = -
393,5 kL/mol; ∆fH0H2O(l) = - 285,5 kL/mol; ∆fH0O2(g)
= 0
∆rH =( 3∆fH0CO2(g)
+ 4∆fH0H2O(l) ) – ( ∆fH0C3H8O3(l)
+ 7/2 ∆fH0O2(g) )
∆rH =[ 3 (-393,5) +4(-285,5) ] – [∆fH0C3H8O3(l)
+ 7/2∙0]
∆rH =-
669,6 kJ
2. m=9,2 g C3H8O3
Q=?
∆rH = -1652,9 kJ⇒ Q = 1652,9 kJ pentru 1 mol de C3H8O3
n=m/M⇒n=9,2/92 ⇒n=0,1 moli C3H8O3
M C3H8O3 = 92 g/mol
1 mol de C3H8O3 …………1652,9
kJ
0,1 mol de C3H8O3 …………x
kJ
x = 165,29 kJ
3. V=600 mL HCl = 0,6 L HCl
Q = 54979,2 J = 54,9792 kJ
Qneutralizare = 57,27 kJ/mol
cmHCl = ?
1 mol HCl ………………..57,27 kJ
x moli HCl………………..54,9792 kJ
x = 0,96 moli HCl
cm = n/V ⇒ cm = 0,96/0,6 ⇒ cm = 1,6 M
4. Se aplică lehea lui Hess.
∆fH0C4H10(g) = ∆rH01
- ∆rH02 +4∆rH03
+ 4∆rH04
5. C(s) + 2S(s) +
87,9 kJ → CS2(l)
Reactanţi + Q → Produşi ; reacţie endotermă
Subiectul G
1. V2O5 este catalizator
2. VO2 =?, t=270C, p=3 atm
V=0,224 m3 SO2 (c.n.) = 224 L
2∙22,4L 1 mol
2SO2(g)
+ O2(g) ⎯⎯⎯→ 2SO3(g)
224L x moli
x = 5 moli O2
T=27+273=300K
Aplicăm pentru O2 : p∙V=n∙R∙T⇒3∙V=5∙0,082∙300 ⇒V=41 L O2.
3. a. Numărul de molecule se calculează cu relaţia: N=n∙NA
12,044 ∙1023 = n∙6,022 ∙1023
n= 2 moli SO2
n=V/22,4 ⇒V=n∙22,4 ⇒V= 2∙22,4 ⇒V=44,8L SO2
b. m=1,6 Kg SO3 = 1600 g
mS =?
MSO3 = 32+3∙16=80 g/mol
80 g SO3 ………………..32 g S
1600 g SO3 ……………..x g S
x= 640 g S
4. A → Produşi
(1)v= k∙ [A]nA
(2)9∙v = k∙ [3A]nA
Se face raportul (1):(2)⇒1/3=1/3nA ⇒nA = 1
5. a. Zn0 + Cu2+ →Zn2+ + Cu0
b. puntea de sare realizează contactul electric între
cele două soluții şi asigură neutralitatea
soluțiilor.


Niciun comentariu:
Trimiteți un comentariu